![]() — Все документы — ГОСТы — ГОСТ Р ИСО 23162-2023 ИССЛЕДОВАНИЕ КАЧЕСТВА СПЕРМЫ БАЗОВОЕ. ТРЕБОВАНИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
— Все документы — ГОСТы — ГОСТ Р ИСО 23162-2023 ИССЛЕДОВАНИЕ КАЧЕСТВА СПЕРМЫ БАЗОВОЕ. ТРЕБОВАНИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
ГОСТ Р ИСО 23162-2023 ИССЛЕДОВАНИЕ КАЧЕСТВА СПЕРМЫ БАЗОВОЕ. ТРЕБОВАНИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
Добавил: Богдан Кривошея
Дата: [28.03.2024]
ГОСТ Р ИСО 23162-2023 ИССЛЕДОВАНИЕ КАЧЕСТВА СПЕРМЫ БАЗОВОЕ. ТРЕБОВАНИЯ И МЕТОДЫ ИССЛЕДОВАНИЙ
Утв. и введен в действие Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2023 г. N 562-ст
Basic semen examination. Specification and test methods
(ISO 23162:2021, IDT)
ОКС 11.100.01
Дата введения - 1 мая 2024 года
Введен впервые
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы "Федерация лабораторной медицины" (Ассоциация "ФЛМ") (Комитетом по молекулярной диагностике инфекционных и неинфекционных заболеваний "ФЛМ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 "Клинические лабораторные исследования и диагностические тест-системы ин витро"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2023 г. N 562-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 23162:2021 "Исследование качества спермы базовое. Требования и методы исследования" (ISO 23162:2021 "Basic semen examination - Specification and test methods", IDT).
Международный стандарт разработан Техническим комитетом ИСО/ТК 212 "Клинические лабораторные исследования и диагностические тест-системы in vitro".
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Настоящий стандарт разработан в связи с обращением международного сообщества относительно необходимости внедрения в практику медицинских лабораторий стандартов исследования спермы человека. В пяти изданиях лабораторного руководства по анализу спермы человека, опубликованных Всемирной организацией здравоохранения (ВОЗ) в период с 1980 по 2010 г., содержатся общие рекомендации по соответствующим лабораторным исследованиям, но даже последнее издание (ВОЗ, 2010 г. [16]) не является техническим стандартом, пригодным для использования в соответствии с требованиями ИСО 15189.
Технический стандарт основан на наилучших лабораторных практиках, имеющих доказательную базу и международное признание в отношении лабораторных исследований, которые, скорее всего, дадут достоверные результаты, облегчат деятельность любой лаборатории, стремящейся обеспечить качество лабораторных исследований. Внедрение стандарта позволит повысить точность результата за счет снижения количества случайных факторов, влияющих на результат. Клинически это способствовало бы улучшению диагностики, а также предоставило бы врачу-клиницисту более объективные основания для выбора как тактики ведения пациента, включая дополнительные виды диагностических исследований, так и методов лечения. Кроме того, для подтверждения оценки и проверки новых методов для улучшения диагностики и лечения бесплодия эти стандартизованные методы могут быть применены в качестве методов межлабораторных сличений.
Подготовка спермы человека к исследованию важна не только при ее базовом исследовании, но и для компьютерного анализа спермы (CASA). Стандартизованная обработка и подготовка образцов спермы необходимы для обеспечения качества получаемых результатов.
1 Область применения
Настоящий стандарт устанавливает минимальные требования к оборудованию и критические аспекты, касающиеся методов исследований, выполняемых лабораториями для базового исследования спермы человека, собранной с использованием эякуляции. Настоящий стандарт применяют ко всему процессу базового исследования спермы, а также к подготовке образцов для компьютерного анализа спермы (CASA).
Настоящий стандарт не относится к исследованиям после вазэктомии.
Примечание 1 - Учитывая судебно-медицинские последствия, связанные с оценкой эякулята после вазэктомии, настоящий стандарт, по всей вероятности, не вполне соответствует определению полностью "чистого" эякулята (т.е. отсутствия сперматозоидов в эякуляте).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 15189, Medical laboratories - Requirements for quality and competence (Медицинские лаборатории. Требования к качеству и компетентности)
ISO/TS 20914, Medical laboratories - Practical guidance for the estimation of measurement uncertainty (Медицинские лаборатории. Практическое руководство по оценке неопределенности измерений)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам:
- платформа онлайн-просмотра ИСО по адресу: http://www.iso.org/obp;
- Электропедия МЭК по адресу: http://www.electropedia.org/.
3.1 дозатор [пипетка] для вытеснения воздуха (air displacement pipette): Лабораторный дозатор с одноразовыми наконечниками, в котором всасываемый объем регулируется перемещением эквивалентного объема воздуха внутри закрытой камеры ручки пипетки.
Примечание 1 - Дозатор для вытеснения воздуха может дать точные объемы только для жидкостей с вязкостью, близкой к вязкости воды.
3.2 азооспермия (azoospermia): Полное отсутствие сперматозоидов в эякуляте (см. 3.4).
Примечание 1 - Термин азооспермия является не клиническим диагнозом, а относится к описанию лабораторных данных. Полное отсутствие сперматозоидов трудно определить в абсолютном выражении. Поскольку только части эякулята (см. 3.4) могут быть изучены, то данное определение основано на вычислениях вероятностей, полученных на основе данных исследований случайных аликвот эякулята (см. 3.4).
3.3 компьютерный анализ спермы; CASA (CASA, computer-aided sperm analysis): Автоматизированное исследование эякулята (см. 3.4) с использованием оборудования, в котором реализованы технологии обработки изображений.
Примечание 1 - Исследование, основанное на анализе изображений видеопоследовательностей, для получения информации о концентрации сперматозоидов (см. 3.18), а также о подвижности сперматозоидов, реже их морфологии.
Примечание 2 - Существуют коммерчески доступные системы компьютерного анализа спермы, но отсутствует общий стандарт для валидации и оценки достоверности результатов исследования или содержания протоколов. В задачи настоящего стандарта не входит предоставление стандартного метода исследования для компьютерного анализа спермы несмотря на то, что аспекты базового исследования могут быть также полезны разработчикам, производителям и пользователям оборудования для компьютерного анализа спермы.
3.4 эякулят (ejaculate): Образец спермы, который представляет собой смесь сперматозоидов и выделений, в основном из семенных пузырьков предстательной железы и придатков яичек.
Примечание 1 - Эякулят можно получить различными способами, включая мастурбацию, половой акт, вибростимуляцию или электроэякуляцию.
3.5 вязкость эякулята (ejaculate viscosity): Свойство эякулята (см. 3.4), описывающее его сопротивление потоку подобно воде после сжижения (см. 3.10).
Примечание 1 - Не полностью разжиженная сперма не является гомогенной жидкостью из-за содержания в эякуляте гелеобразных структур.
3.6 поле большого увеличения (high power field): Площадь предметного стекла, видимая в микроскоп при большом увеличении (400x).
Примечание 1 - Это не стандартная область поля зрения, поскольку ее размер варьируется в зависимости от типа используемых окуляров (например, стандартного или широкопольного) (см. приложение B).
3.7 неподвижный (immotile): Полное отсутствие активных движений хвоста сперматозоида.
3.8 межлабораторное сличение (interlaboratory comparison): Организация, выполнение и оценивание измерений или испытаний одного и того же или нескольких подобных образцов двумя или более лабораториями в соответствии с заранее установленными условиями.
[ИСО/МЭК 17043:2010, 3.4]
3.9 нормальный сперматозоид (ideal spermatozoon): Сперматозоиды с типичной для сперматозоидов морфологией, способные проникать и мигрировать в цервикальную слизь и достигать места оплодотворения.
[[9], [10]]
3.10 сжижение (liquefaction): Процесс изменения консистенции эякулята (см. 3.4) из гелеобразного или коагулообразного состояния в жидкую фазу.
Примечание 1 - Разжижение происходит из-за деградации гелеобразных или коагулообразных свойств спермы при воздействии ферментов на макромолекулы.
3.11 непоступательная подвижность сперматозоидов (non-progressive sperm motility): Активные движения хвоста сперматозоида, приводящие к передвижению сперматозоидов со скоростью менее 5 мкм/с.
Примечание - Морфологическая норма длины головки составляет приблизительно 5 мкм.
3.12 дозатор [пипетка] с принудительным вытеснением (positive displacement pipette): Лабораторный дозатор, работающий за счет перемещения поршня внутри капилляра, а не за счет перемещения воздуха в закрытой камере.
Примечание 1 - Поршень в наконечнике дозатора находится в непосредственном контакте с жидким образцом.
Примечание 2 - Используют, чтобы избежать существенных ошибок при взятии объема биологического материала при работе с вязкими жидкостями, такими как сперма.
3.13 поступательная подвижность сперматозоидов (progressive sperm motility): Активные движения хвоста сперматозоида, приводящие к движению сперматозоидов по прямой траектории со скоростью не менее 5 мкм/с.
Примечание 1 - См. также медленную поступательную подвижность сперматозоидов (см. 3.16) и быструю поступательную подвижность сперматозоидов (см. 3.14).
Примечание 2 - Сперматозоиды, совершающие вращательные движения, считают поступательными на основании увеличения пространства при их движении.
3.14 быстрая поступательная подвижность сперматозоидов (rapid progressive sperm motility): Активные движения хвоста сперматозоида, приводящие к движению сперматозоидов по прямой траектории со скоростью более 25 мкм/с.
3.15 половое воздержание (sexual abstinence): Время между сбором эякулята (см. 3.4) для исследования и предыдущей эякуляцией.
Примечание 1 - Выражают в днях или часах в зависимости от предполагаемого применения.
3.16 медленная поступательная подвижность сперматозоидов (slow progressive sperm motility): Активные движения хвоста сперматозоида, приводящие к движению сперматозоидов по прямой траектории со скоростью не менее 5 мкм/с, но не более 25 мкм/с.
3.17 контейнер для сбора образцов (specimen collection container): Емкость, используемая для сбора первичных образцов.
Примечание 1 - Контейнер для сбора образцов не должен быть токсичным для сперматозоидов.
Примечание 2 - Если эякулят (см. 3.4) собирают во время полового акта, то можно использовать нетоксичные презервативы, например SilasticTM. Эякулят (см. 3.4) после поступления в лабораторию для проведения исследования необходимо переместить в контейнер для образцов эякулята, информация о таких действиях должна быть занесена в протокол.
3.18 концентрация сперматозоидов (sperm concentration): Количество сперматозоидов в единице объема.
Примечание 1 - Концентрацию сперматозоидов выражают в миллионах или тысячах миллилитров.
Примечание 2 - Не следует путать с плотностью сперматозоидов (масса/объем).
3.19 жизнеспособность сперматозоидов (sperm vitalit): Процент жизнеспособных сперматозоидов независимо от их способности двигаться.
3.20 общее количество сперматозоидов (total sperm number): Вычисленное общее количество сперматозоидов в эякуляте (см. 3.4).
Примечание 1 - Общее количество сперматозоидов - это концентрация сперматозоидов (см. 3.18), умноженная на объем эякулята (см. 3.4).
Примечание 2 - Общее количество сперматозоидов отличается от концентрации сперматозоидов (см. 3.18).
3.21 строгие тайгербергские критерии (Tygerberg strict criteria): Критерии, основанные на морфологии сперматозоидов, способных проникать в цервикальную слизь и мигрировать в ней.
3.22 индекс тератозооспермии; TZI (Teratozoospermia Index, TZI): Среднее количество дефектных областей (головка, шейка/средняя часть, хвост и/или цитоплазматическая капля) в аномальных сперматозоидах.
Примечание 1 - Этот индекс не выходит за пределы интервала [1,00; 4,00].
4 Обучение и компетентность персонала
4.1 Общие аспекты
Общие требования к обучению и компетентности персонала изложены в ИСО 15189. Применение этих требований к анализу спермы человека приведено в настоящем стандарте.
4.2 Обучение
4.2.1 Общие положения
Исследование спермы включает в себя множество аналитических процессов, которые требуют обучения специалиста, чтобы свести к минимуму субъективность и обеспечить достоверные результаты [7], [12], [1].
4.2.2 Подготовка по вопросам выполнения количественных исследований
Все специалисты, выполняющие исследование подвижности сперматозоидов, концентрации сперматозоидов, жизнеспособности сперматозоидов и/или морфологии сперматозоидов, должны пройти обучение с использованием коммерческих или собственных контрольных материалов, чтобы гарантировать, что их результаты соответствуют заранее установленным лабораторным пределам погрешности измерения. Такое обучение позволит персоналу получать точные и достоверные результаты исследований, а участие в межлабораторных сличениях становится целесообразным.
Примечание - Эффективные целенаправленные процедуры повторного обучения приведены в [12], [14], ожидается, что диапазон погрешности измерений результатов исследований специалистами, завершившими обучение, и опытным персоналом лаборатории составит не более ± 10% (см. также приложение C).
4.2.3 Подготовка по вопросам выполнения качественных исследований
Обучение навыкам проведения качественных исследований, например исследования вязкости спермы, формы головки сперматозоида, должно привести к сходимости результатов между завершившими обучение специалистами и опытным персоналом по крайней мере в 90% случаев.
4.2.4 Подготовка по вопросам измерения pH
Должна быть проверена способность специалистов, завершивших обучение, учитывать показания тест-полосок по шкале сравнения.
4.3 Поддержание компетентности
Текущая проверка компетентности должна быть продемонстрирована всеми специалистами лаборатории, выполняющими исследование спермы, через установленные промежутки времени в соответствии с требованиями системы менеджмента качества лаборатории.
Примечание - В соответствии с 4.2 тот же диапазон ± 10% погрешности измерения ожидается для текущей проверки компетентности всего обученного персонала, выполняющего исследование спермы.
5 Характеристика спермы, сбор образцов и обработка перед исследованием
5.1 Общие характеристики
Исследование эякулята отличается от исследований других жидкостей человеческого организма. Предполагается, что пациент самостоятельно соберет эякулят. Результаты исследований зависят от частоты эякуляций перед сбором спермы, а также от времени и температуры хранения спермы до начала исследований. В случае диагностики бесплодия отсутствуют четкие референтные интервалы, поскольку результат зависит от конкретной клинической ситуации каждой пары, стремящейся к зачатию ребенка.
5.2 Физические и химические характеристики
В эякуляте, собранном в контейнер для проведения лабораторных исследований, отсутствует внутренний гомеостатический контроль. В момент семяизвержения сперма имеет жидкую консистенцию, без комочков и включений, затем эякулят переходит в гелеобразное состояние. Это естественный процесс, необходимый для защиты сперматозоидов от негативных внешних воздействий, затем сперма снова становится жидкой. Во время этого процесса углекислый газ испаряется, вызывая изменение pH. Ферментативная деградация компонентов геля вызывает значительное повышение осмотических свойств жидкости, окружающей сперматозоиды, что в свою очередь влияет на работоспособность сперматозоидов.
5.3 Сбор образцов спермы и их первоначальная обработка
Сбор образцов спермы всегда должен проводиться самим пациентом, за исключением случаев, когда мужчины имеют инвалидность конечностей, травму спинного мозга или паралич нижних конечностей. При необходимости партнер пациента может помочь со сбором образцов. Для пациента с этическими или религиозными возражениями против мастурбации неспермотоксичный (SilasticTM) <1> презерватив можно использовать для сбора эякулята во время полового акта. Однако этот метод сбора приведет к некоторой потере количества образца спермы, поскольку сперма будет извлечена из презерватива. Сбор эякулята путем прерванного полового акта ("отмены") не рекомендуется, так как часто теряется первая, богатая спермой фракция эякулята. Некоторым пациентам может потребоваться использование смазочных материалов; такие продукты должны быть нетоксичны для сперматозоидов [13].
--------------------------------
<1> SilasticTM является примером подходящего продукта. Данная информация приведена для удобства пользователей настоящего стандарта и не означает одобрения ИСО этого продукта.
После эякуляции образец должен храниться при температуре, близкой к 37 °C (не выше); охлаждение или нагревание могут вызвать артефакты и дисфункцию сперматозоидов. В связи со всеми изменениями, происходящими после эякуляции, исследование следует начинать как можно раньше после разжижения, которое обычно завершается в течение 30 мин после эякуляции. Неполное разжижение через 60 мин после эякуляции указывает на аномалию. Начало исследования после завершения разжижения в большей степени достигается, если эякулят собирают в максимальной близости от лаборатории. Поскольку продолжительность и уровень сексуального возбуждения, которые испытывает пациент, будут влиять на эякуляцию, сбор образцов следует проводить в месте, выбранном пациентом. Когда эякулят собирают за пределами лаборатории, он должен быть доставлен в лабораторию в течение 30 мин, но не более чем в течение 60 мин (обстоятельства сбора и транспортирования эякулята должны быть зафиксированы в протоколе). Соблюдение требований к температуре хранения и времени доставки в лабораторию является важным фактором для обеспечения качества и надежности результатов исследования.
5.4 Информация о пациенте и сбор данных
5.4.1 Информация, предоставляемая пациенту
Информация, предоставляемая пациенту в письменной форме на понятном ему языке:
a) общая информация:
- контактные данные лаборатории,
- причина проведения исследования, если информация получена от пациента,
- виды исследований,
- способ передачи результатов лабораторных исследований;
b) сбор, обработка и транспортирование эякулята:
- способ сбора эякулята,
- влияние задержки между сбором образца и началом исследования,
- информирование о важности соблюдения температурных параметров для хранения эякулята,
- информирование о значимости длительного полового воздержания,
- информирование о важности сообщения о любой причине сбора образца не в полном объеме.
5.4.2 Сбор данных от пациента
a) Необходимая информация
Каждому пациенту предлагают предоставить следующую информацию, которая будет документально зафиксирована лабораторией:
- достаточные для идентификации данные пациента (не менее двух уникальных идентификаторов, относящихся к пациенту и указанных направившей организацией);
- продолжительность полового воздержания;
- время сбора образца;
- следует избегать транспортирования эякулята, однако, если эякулят собран не в помещении лаборатории, необходимо подтвердить соблюдение условий и времени транспортирования образца в лабораторию;
- полнота сбора эякулята с первой до последней капли; в случае неполного сбора необходимо указать, какие части в последовательности эякуляции пропущены.
b) Дополнительная информация
Информация, которая является значимой для клинической интерпретации результатов исследования (однако сбор такой информации не является частью лабораторной деятельности):
- история болезни, которая может включать:
- любой эпизод тяжелого воспалительного процесса за последние три месяца,
- любые предшествующие хирургические вмешательства (паховая грыжа, варикоцеле, крипторхизм или другие проблемы, связанные с мочеполовой сферой) или лечение химиотерапией, цитостатиками или облучением мочеполовых органов,
- любое использование фармацевтических препаратов, за исключением краткосрочного использования безрецептурных препаратов (например, болеутоляющих и противоаллергических препаратов);
- любое использование наркотиков, анаболических стероидов или других пищевых добавок, повышающих работоспособность (например, протеиновых порошков).
5.5 Начальная обработка образца
Каждый эякулят следует считать потенциально инфекционным и обращаться с ним соответствующим образом (см. ИСО 15190:2020, приложение B).
Информация, предоставленная пациентом, должна быть задокументирована.
Контейнер для сбора образцов должен быть чистым, нетоксичным и одноразовым.
Контейнер для сбора образцов рекомендуется взвесить перед сбором образцов, полученное числовое значение указывают в граммах с точностью до двух десятичных знаков.
Объем эякулята рекомендуется определять по весу. В этом случае контейнер для сбора образцов взвешивают, полученное числовое значение указывают в граммах с точностью до двух десятичных знаков до и после сбора образцов, а разницу результатов взвешивания используют как объем, принимая, что 1,0 г эякулята равен 1,0 мл эякулята [3]. Если используют калиброванную серологическую пипетку, то некоторое количество спермы всегда будет оставаться в контейнере для сбора образцов и внутри пипетки после проведения исследования. В лаборатории должны быть разработаны документированные процедуры выполнения указанных методов определения объема эякулята. Объем эякулята указывают в миллилитрах с точностью до одного десятичного знака.
Все документы и контейнер для сбора образцов должны быть промаркированы как минимум двумя уникальными идентификаторами.
В максимально короткие сроки после сбора эякулята контейнер для сбора образцов должен быть помещен в контейнер для транспортирования образцов с поддержанием температуры от 35 °C до 37 °C для облегчения процесса разжижения и для подготовки к исследованию подвижности сперматозоидов при вышеуказанной температуре, предпочтительно на подвижном лотке для улучшения перемешивания во время разжижения (когда движущийся лоток недоступен, необходимо частое ручное перемешивание).
На сперматозоиды действует гравитация земли, поэтому они оседают на дно любого контейнера ("геотаксис"), даже если они подвижны. Следовательно, образец необходимо тщательно перемешать, чтобы равномерно распределить сперматозоиды и другие элементы эякулята. Даже сидение пациента в течение короткого периода времени приведет к неравномерному распределению клеточных элементов эякулята. Поэтому необходимо тщательно перемешать эякулят перед взятием любой аликвоты для исследования, учитывая, что не допускается использовать вихревой смеситель.
5.6 Исследование токсичности спермы
Для того чтобы убедиться в том, что материалы, контактирующие с эякулятом (контейнер для сбора образцов, наконечники дозаторов), не являются токсичными для сперматозоидов, рекомендуется для каждой новой партии таких материалов проводить входной контроль на токсичность. Принцип указанного контроля основан на сравнении подвижности сперматозоидов, подвергшихся воздействию настоящего и нового материалов [6]. Время воздействия должно как минимум в два раза превышать ожидаемое время воздействия материала на сперму: секунды - для наконечников дозаторов и от 30 до 60 мин - для контейнеров для сбора образцов.
6 Порядок проведения исследований
6.1 Оборудование
Подвижность сперматозоидов в значительной степени зависит от температуры окружающей среды, особенно в отношении скорости их движения.
Использование оборудования с регулируемой температурой снижает влияние факторов изменения комнатной температуры.
Для проведения исследования применяют следующее оборудование:
- лабораторные весы с диапазоном от 0,00 до 50,00 г (показания с точностью до двух десятичных знаков);
- инкубатор или теплая тарелка, в которых можно поддерживать температуру эякулята, соответствующую температуре человеческого тела, предпочтительно с подвижным лотком (орбитальный смеситель);
- вертикальный оптический микроскоп с фазово-контрастной (рекомендуются объективы с кратностью увеличения 10x, 20x и 40x) и светлопольной (с кратностью увеличения 100x, масляной иммерсией, объективом высокого разрешения) оптикой, а также увеличением окуляра 10x и окулярным микрометром (или окулярной сеткой, или калиброванной сеткой с микрометрической шкалой столика), а также средства поддержания температуры влажных препаратов, соответствующей температуре тела (например, столик с подогревом);
- поршневой дозатор для исследования концентрации сперматозоидов вместимостью от 0 до 50 мкл или от 0 до 100 мкл;
- дозатор с вытеснением воздуха (объемом от 1 до 20 мкл, от 20 до 200 мкл и от 200 до 1000 мкл) для разбавителя, влажных препаратов и других препаратов;
- оборудование для окрашивания и подготовки к исследованию морфологических и витальных препаратов (держатели стекол, банки для окрашивания, одноразовые пипетки для заливки сред);
- центрифуга (например, для конических центрифужных пробирок вместимостью 15 мл) - поворотный ротор с качающимися стаканами предпочтительнее для получения более дискретных гранул - и либо герметичные поворотные роторы, либо герметичный ротор для защиты операторов от возможного загрязнения аэрозолем в случае повреждения пробирки во время центрифугирования;
- гемоцитометры с усовершенствованной линейкой Нэйбауэра (глубина 100 мкм).
Примечание 1 - Большинство международных экспертов рекомендуют использовать гемоцитометр с улучшенной шкалой Нэйбауэра [12], [14], [16]. Можно использовать другие гемоцитометры при условии применения расчетных коэффициентов.
Примечание 2 - Многоразовые гемоцитометры необходимо регулярно проверять, чтобы износ не приводил к изменению глубины камеры. Одноразовые гемоцитометры можно использовать при условии, что они должным образом валидированы [5].
Примечание 3 - Камеры Маклера имеют более низкую точность, чем гемоцитометры [17].
Примечание 4 - Некоторые одноразовые счетные камеры, предназначенные для анализа мочи, имеют для этой цели недостаточную точность [17].
Примечание 5 - Камеры фиксированной глубины, использующие капиллярное действие, подвержены эффекту Сегре-Зильберберга и, следовательно, будут иметь систематическую погрешность [4];
- влажная камера для оседания сперматозоидов в гемоцитометрах;
- вихревой смеситель (для перемешивания фиксированных суспензий сперматозоидов для оценки концентрации сперматозоидов).
6.2 Реагенты собственного производства
Разбавитель для оценки концентрации сперматозоидов может быть приготовлен самостоятельно (см. приложение D). Цель состоит в том, чтобы обездвижить (убить) сперматозоиды, чтобы сделать подсчет более надежным. Также является преимуществом предотвращение роста микроорганизмов.
6.3 Проведение исследования
6.3.1 Начало исследования
Для достоверной оценки характеристик эякулята необходимо провести его разжижение. Для большинства эякулятов это достигается в течение 30 мин, если их хранят после сбора при температуре 37 °C. Если разжижение не завершено, образец можно оставить в инкубаторе на дополнительный период времени (максимум 30 мин, чтобы можно было оценить подвижность в течение 60 мин после сбора), после чего следует начать исследование. Неполное разжижение в начале исследования, а также время между сбором эякулята и началом исследования влажного препарата должно быть зафиксировано в протоколе.
6.3.2 Макроскопическое исследование эякулята
При отсутствии метрологических эталонов физических характеристик человеческой спермы невозможно добиться надлежащей стандартизации методов или установить неопределенность измерения. Однако некоторые наблюдения, касающиеся цвета или восприятия его запаха, могут иметь клиническое значение в отношении образца или медицинского статуса пациента. Следовательно, любые комментарии, включенные в протокол, являются описанием наблюдаемых характеристик, выходящих за рамки ожидаемых.
a) Внешний вид эякулята:
1) цвет (норма: молочный, серовато-белый, желтоватый, слегка опалесцирующий; отклонения от нормы: коричневатый или красный, прозрачный, ярко-желтый);
2) разжижение (должно завершиться в течение 30 мин после эякуляции при температуре 37 °C; отклонение от нормы: наличие оставшихся комков геля).
b) Другие физические наблюдения:
1) вязкость - измеряют путем медленного стекания спермы под действием силы тяжести из пипетки с широким отверстием (например, серологические пипетки вместимостью 5 мл или нетоксичные стеклянные или пластиковые пипетки Пастера). Норма: дискретные капли с "нитями" <2 см;
2) запах (у спермы отсутствует "нормальный" запах, и ее запах весьма субъективен. Однако сильный гнилостный запах часто указывает на активную инфекцию; слабый гнилостный запах может свидетельствовать о длительном воздержании; сильный запах мочи может указывать на загрязнение спермы мочой);
3) pH спермы - измеряют в течение 30 мин после сбора эякулята; в случае отсутствия сперматозоидов и небольшого объема спермы допустимо нанесение аликвоты разжиженной спермы на тест-полоску pH.
6.3.3 Прямая микроскопия влажного препарата
Влажный препарат готовят, помещая 10 мкл аликвоты тщательно перемешанной спермы на маркированное, предварительно подогретое, предметное стекло и накрывая его предварительно нагретым покровным стеклом размером 22 x 22 мм (толщина N 1 1/2 или N 2, чтобы обеспечить полное распределение капли) для получения глубины препарата около 20 мкм (для покровных стекол размером 18 x 18 мм требуется только 6,5 мкл аликвоты для получения такой же глубины).
Наблюдают за наличием сперматозоидов, других клеток, кристаллов.
Обращают внимание на наличие агглютинатов и агрегатов сперматозоидов.
Оценивают подходящее разведение для исследования концентрации сперматозоидов (см. приложение E).
Клеточные и неклеточные элементы, которые могут присутствовать в эякуляте пациента, не имеют стандартных образцов и, следовательно, не могут быть объективно оценены, в том числе и с использованием описаний качественных характеристик. Однако некоторые наблюдения могут иметь клиническое значение в отношении медицинского статуса пациента. Таким образом, любые комментарии, включенные в протокол, следует рассматривать как сделанные в порядке исключения, т.е. как попытки описать наблюдения, выходящие за рамки ожидаемых. Лаборатория должна гарантировать, что она может продемонстрировать минимальную разницу между результатами исследования, полученными разными специалистами.
6.3.4 Исследование подвижности сперматозоидов
Должны быть приготовлены два независимых влажных препарата из тщательно перемешанного образца, хранившегося при температуре от 35 °C до 37 °C.
В каждой повторности необходимо оценивать не менее четырех различных полей видимости.
В каждой повторности должно быть классифицировано не менее 200 сперматозоидов.
Каждый исследованный сперматозоид необходимо отнести к соответствующему классу в зависимости от его подвижности: как быстро движущийся по прямолинейной траектории (быстрая поступательная подвижность сперматозоида); медленно движущийся по прямолинейной траектории (медленная поступательная подвижность сперматозоида); подвижный, однако не обладающий поступательной подвижностью по прямой; неподвижный (см. таблицу 1).
Таблица 1 - Определение классов подвижности сперматозоидов
|
Класс |
Тип подвижности |
|
Быстрая поступательная подвижность (a) |
Активные движения хвоста сперматозоида, скорость движения не менее 25 мкм/с |
|
Медленная поступательная подвижность (b) |
Активные движения хвоста сперматозоида, скорость движения не менее 5 мкм/с, но не более 25 мкм/с |
|
Непоступательная подвижность (c) |
Активные движения хвоста сперматозоида, скорость движения от 0 до 4 мкм/с |
|
Отсутствие подвижности (d) |
Отсутствие активных движений хвостом |
Примечание 1 - В каждом поле видимости сначала подсчитывают сперматозоиды, обладающие быстрой и медленной поступательной подвижностью, затем сперматозоиды с непоступательной подвижностью и неподвижные сперматозоиды в пределах одного поля видимости. Если концентрация сперматозоидов высока, рекомендуется подсчитывать только те сперматозоиды, которые видны в меньшем поле зрения, например: в четырех центральных квадратах сетки счетной камеры или сетки окуляра.
Примечание 2 - Подвижные и неподвижные сперматозоиды, связанные в агглютинаты или агрегаты, не учитывают для определения класса подвижности. Если предполагается, что более 20% - 25% сперматозоидов застревают в таких скоплениях и, следовательно, не учитываются для определения класса подвижности, то такая информация должна быть зафиксирована в протоколе.
Для вычисления результата с ожидаемой точностью и неопределенностью измерения необходима воспроизводимость двух повторных исследований (см. приложение F).
6.3.5 Исследование концентрации сперматозоидов
Из тщательно перемешанного образца спермы берут аликвоту объемом 50 или 100 мкл (точный объем набирают с помощью поршневого дозатора) в зависимости от предполагаемой концентрации сперматозоидов (см. приложение E).
Аликвоту разбавляют (см. приложение E; объем зависит от результатов исследования влажного препарата) для иммобилизации сперматозоидов и достижения концентрации, которую можно с уверенностью подсчитать на гемоцитометре.
Тщательно перемешанную аликвоту суспензии сперматозоидов загружают в одну сторону счетной камеры. Вторую точно так же перемешанную аликвоту из той же суспензии сперматозоидов загружают в другую сторону счетной камеры. Затем счетную камеру оставляют в горизонтальном положении не менее чем на 10 мин во влажной камере, чтобы обеспечить осаждение сперматозоидов на сетке счетной камеры. Если прошло более 20 мин, необходимо проверить влажность в камере.
Исследование второй части аликвоты проводят путем сравнения не менее 200 сперматозоидов в каждом повторе, за исключением тех случаев, когда подсчет невозможен, например концентрация сперматозоидов менее 1 миллиона на миллилитр.
Рекомендуется использовать не менее 200 сперматозоидов в повторностях для снижения погрешности измерения (95%-ный доверительный интервал) до не более ± 10%. Если оценивают не менее 100 сперматозоидов в повторе, соответствующая погрешность измерения составляет не более ± 14%. Любой результат, основанный на менее чем 200 наблюдаемых сперматозоидах, должен быть прокомментирован в протоколе.
Для вычисления результата с ожидаемой точностью и неопределенностью измерения необходима воспроизводимость двух повторных исследований (см. приложение G).
6.3.6 Исследование отсутствия сперматозоидов
Тщательный, систематический визуальный осмотр (увеличение от 200x до 400x; сканирование всей области под покровным стеклом размером 22 x 22 мм) двух независимых аликвот по 10 мкл без обнаружения сперматозоидов в счетной камере является первой частью исследования. Вторая часть представляет собой осмотр всей площади счетной камеры, содержащей 10 мкл осадка всего эякулята после центрифугирования (1000 x g, 15 мин), под покровным стеклом размером 22 x 22 мм. Если сперматозоиды не обнаружены ни при одном из этих визуальных осмотров, считают достаточным, чтобы клиническая лаборатория подтвердила, что эякулят вряд ли содержит сперматозоиды, хотя присутствие случайных сперматозоидов не может быть исключено (см. приложение A).
6.3.7 Оценка жизнеспособности сперматозоидов
Жизнеспособность сперматозоидов обычно не исследуют в эякуляте, а только если при исследовании влажного препарата выявлен низкий процент подвижных сперматозоидов, например менее 40% общей подвижности.
Используют валидированный и проверенный метод для определения живых и мертвых сперматозоидов, например: тщательно перемешанная сперма, смешанная с комбинированным суправитальным красителем с фоновым красителем, такими как эозин Y и нигрозин [2] (см. приложение H).
Примечание - Тест на жизнеспособность только с эозином валидирован только для отрицательной фазово-контрастной микроскопии.
6.3.8 Исследование морфологии сперматозоидов
Мазки для исследования морфологии сперматозоидов рекомендуется готовить в течение 60 мин после сбора эякулята (см. приложение I). Продолжительное воздействие разжиженного эякулята может увеличить наличие скрученных хвостов сперматозоидов из-за постоянного увеличения осмоляльности эякулята.
Каждый сперматозоид должен быть исследован в отношении наличия аномалий головки, шейки и средней части, хвоста сперматозоида и остаточной цитоплазматической массы (см. приложение I). Для исследования подходят только цельные сперматозоиды (с головкой и хвостом). Если на 100 цельных сперматозоидов приходится более 20 незакрепленных головок, количество незакрепленных головок указывают отдельно как количество незакрепленных головок на 100 цельных сперматозоидов.
Для проведения исследований морфологии сперматозоидов необходимо обучение специалистов с использованием контрольных материалов (например, мазки, окрашенные красителем по Папаниколау или другими валидированными методами с подтвержденными результатами). Без этого обучения, а также постоянной проверки компетентности персонала результаты исследований не будут иметь научной и клинической значимости.
7 Обработка результатов и протокол результатов исследований
7.1 Общие положения
Результаты исследований включают подсчет сперматозоидов и обработку результатов.
В каждой лаборатории необходимо определить неопределенность измерения в соответствии с ISO/TS 20914.
7.2 Расчеты и представление результатов
7.2.1 Общее количество сперматозоидов в эякуляте
Концентрацию сперматозоидов в эякуляте сложно интерпретировать правильно, поскольку конечный объем эякулята зависит от функционирования эндокринных желез, регуляция которых время от времени может изменяться у одного и того же пациента, а также между эякулятами разных пациентов. Поэтому следует также вычислить объем эякулята:
- общее количество сперматозоидов равно объему эякулята, умноженному на концентрацию сперматозоидов.
7.2.2 Другие расчеты
a) Подвижность
Подвижность сперматозоидов вычисляют на основе среднего значения двух проведенных повторных исследований и представляют в виде процентов (исходя из количества подсчитанных сперматозоидов используют только целые значения):
- быстрая поступательная подвижность сперматозоидов;
- медленная поступательная подвижность сперматозоидов;
- непоступательная подвижность сперматозоидов;
- отсутствие подвижности.
Помимо указанных данных могут быть вычислены и представлены в виде процентов (результат представляют как целое число) следующие результаты исследований:
- процент сперматозоидов, обладающих поступательной подвижностью (двигающихся по прямой) (быстрая + медленная поступательная подвижность сперматозоидов);
- процент подвижных сперматозоидов (быстрая + медленная поступательная подвижность сперматозоидов + непоступательная подвижность сперматозоидов).
Примечание - Оценка подвижности по четырем категориям, включая различие между быстрой и медленной поступательной подвижностью сперматозоидов, дает важную информацию для принятия клинических решений [1].
b) Морфология
Основываясь на количестве подсчитанных сперматозоидов (где результат представляют как целое число) и индексе тератозооспермии (TZI) (где результат представляют с точностью до двух десятичных знаков), проводят морфологию сперматозоидов:
- процент "идеальных" сперматозоидов [15];
- процент зарегистрированных аномалий (головка, шейка/средняя часть, хвост или цитоплазматический остаток) от всех оцененных сперматозоидов (т.е. не только их распространенность среди аномальных сперматозоидов);
- конкретные аномалии [например, сперматозоиды с округлой головкой (т.е. глобозооспермия), сперматозоиды с грушевидной формой головки, свободные головки сперматозоидов] необходимо указывать отдельно для каждой аномалии, если их количество более чем 20 на 100 сперматозоидов;
- индекс TZI, являющийся необязательным; его вычисляют как общее количество видимых дефектных областей [головка, шейка (средняя часть), хвост и цитоплазматический остаток], деленное на количество аномальных сперматозоидов, в которых они были подсчитаны (указанные результаты представляют с точностью до двух десятичных знаков).
7.3 Представление результатов
7.3.1 Общие положения
Результаты исследований представляют в виде процентов (целое число).
В случае применимости индекса TZI результат всегда указывают с точностью до двух десятичных знаков.
Концентрация и количество сперматозоидов: результат представляют как целые значения для результатов не менее 10 млн; для значений от 0,05 до 9,95 млн результат представляют с точностью до одного десятичного знака для наглядности в целях интерпретации результатов. Для более низких значений, например до 0,05 млн, результат представляют в тысячах вместо миллионов, чтобы уточнить приблизительный характер полученного числа (например, 40 тыс. вместо 0,04 млн).
7.3.2 Содержание протокола исследования спермы
Помимо требований, указанных в ИСО 15189, должны быть включены следующие данные, относящиеся к исследованию эякулята:
- продолжительность полового воздержания, дни;
- информация о том, был ли эякулят собран в лаборатории или в другом месте и доставлен в лабораторию. В последнем случае время доставки в лабораторию также должно быть зафиксировано в протоколе исследования;
- вязкость, разжижение и другие макроскопические наблюдения;
- объем эякулята, мл;
- концентрация сперматозоидов, млн/мл;
- общее количество сперматозоидов в миллионах на эякулят;
- для эякулятов без сперматозоидов во влажном препарате (10 мкл) в протокол исследования включают информацию о любых наблюдаемых сперматозоидах в осадке после центрифугирования эякулята;
- процент подвижности;
- проценты морфологии и TZI (если проводился расчет);
- процент живых сперматозоидов, если он вычислен;
- pH при измерении;
- другие существенные или необычные результаты, обнаруженные при микроскопическом исследовании влажного препарата, например агрегаты и агглютинаты, наличие круглых клеток, дебриса и кристаллов.
Примечание 1 - Дифференциация между различными типами круглых клеток в эякуляте часто затруднена. Выявление лейкоцитов в эякуляте иногда может свидетельствовать о наличии воспалительного процесса в организме человека, а мазки, окрашенные по Папаниколау (или другим валидированным методом), могут выявлять в том числе присутствие незрелых зародышевых клеток (сперматиды, сперматоциты или, в редких случаях, сперматогонии), но четкое различие между ними часто невозможно. Однако в руководстве ВОЗ рекомендуется включать в протокол исследования более 1 млн пероксидазоположительных клеток на миллилитр (ВОЗ, 2010 г.) [16];
- наблюдения за необычными физическими характеристиками эякулята, например цветом, запахом, вязкостью (см. 6.3.1 и 6.3.2).
Примечание 1 - Ответственность за интерпретацию и консультирование по протоколу исследования спермы возлагают на клиницистов, направивших пациента на исследование.
7.4 Практические аспекты обеспечения качества
7.4.1 Внутренний контроль качества
В лаборатории должен быть внедрен внутренний контроль качества (ВКК) для выявления аспектов несоответствующей лабораторной деятельности, происходящих из-за дефекта используемых реагентов, оборудования, расходных материалов, а также из-за неправильного применения стандартных операционных процедур или ненадлежащего обучения специалистов.
Контрольные материалы для исследования подвижности сперматозоидов (изображения видеопоследовательностей) и фиксированные окрашенные предметные стекла для исследования морфологии и жизнеспособности сперматозоидов, соответственно, могут быть изготовлены лабораторией и сохранены для повторного использования или получены при участии в межлабораторных сличениях.
Предварительно разбавленные и фиксированные образцы спермы не стабильны, а следовательно, необходимо валидировать методы подготовки контрольных материалов для их применения в течение длительного времени для мониторинга качества исследования концентрации сперматозоидов. Кроме того, можно использовать альтернативные методы для проверки точности подсчета сперматозоидов с применением таких контрольных материалов, как латексные сферы. Контрольные материалы в форме изображений видеопоследовательностей подвижных сперматозоидов не могут оценить все аспекты подвижности сперматозоидов, однако их использование необходимо для оценки компетентности каждого специалиста в наиболее значимой части исследования подвижности, а именно в определении разных классов подвижности сперматозоидов.
7.4.2 Внутрилабораторные сличения
Один и тот же образец спермы должен быть исследован в лаборатории для подтверждения сходимости результатов между специалистами, осуществляющими данные исследования. Указанные исследования должны проводиться периодически для подтверждения сходимости результатов с использованием одного и того же контрольного материала.
Концентрация сперматозоидов. После разведения свежей спермы фиксирующим растворителем фактический подсчет сперматозоидов не должен зависеть от времени (в пределах временного интервала от нескольких часов до нескольких дней в зависимости от герметичности емкости для разведения и прилипания сперматозоидов к ее стенкам). Основной проблемой является общее увеличение агрегации сперматозоидов, что снижает концентрацию свободных сперматозоидов.
Подвижность сперматозоидов. Достоверную оценку сравнения получить сложно из-за изменений подвижности сперматозоидов в эякуляте. Изображения видеопоследовательностей подвижности сперматозоидов являются методическим материалом для индивидуальной оценки подвижности сперматозоидов. Для достоверности контроля качества с помощью изображений видеопоследовательностей важно, чтобы наблюдаемые видеофрагменты представлялись специалисту таким же образом, как при обычном исследовании эякулята. Поэтому рекомендуется визуальная оценка с использованием тех же изображений видеопоследовательности или просмотра влажного препарата на экране компьютера, что и для проведения контроля качества.
Примечание - В настоящем стандарте не рассматривают оценку подвижности с помощью компьютерного анализа спермы.
Морфология сперматозоидов. Оценка индивидуальной изменчивости может быть выполнена с фиксированными, окрашенными и подготовленными мазками.
Жизнеспособность сперматозоидов. Оценка межиндивидуальной изменчивости может быть выполнена на окрашенных и подготовленных мазках.
Должен быть проведен анализ результатов, полученных разными специалистами, с целью установления временного интервала, в рамках которого результаты исследования считаются достоверными. В лаборатории необходимо определить частоту внутрилабораторных сличений с учетом оценки риска для каждой характеристики спермы, а также тех целей, которые должны быть достигнуты для различных измеряемых параметров.
7.4.3 Межлабораторные сличения
Каждая лаборатория, выполняющая визуальное исследование спермы, также должна участвовать в межлабораторных сличениях, касающихся, по крайней мере, основных характеристик эякулята (концентрация сперматозоидов, подвижность, морфология и жизнеспособность), исследованных и зарегистрированных лабораторией.
Примечание - Программы межлабораторных сличений обеспечивают целевые значения результата исследования и не полагаются только на средние значения результатов участвующих лабораторий, специалисты которых обладают различным опытом и компетенциями.
Приложение A
(справочное)
Определение отсутствия сперматозоидов
В таблице A.1 приведен расчет вероятности присутствия сперматозоидов в тех условиях, когда сперматозоиды не наблюдались во всей аликвоте эякулята объемом 20 мкл [доверительный интервал (ДИ); распределение Пуассона].
Примечание - GraphPad QuickCalcs валидированы 15 сентября 2018 г. https://www.graphpad.com/quickcalcs. Доверительный интервал применяют для того, чтобы подтвердить, что даже если в аликвоте эякулята объемом 20 мкл не наблюдалось сперматозоидов, истинное значение количества сперматозоидов с вероятностью 99,5% составляет до 1325 сперматозоидов в эякуляте объемом 5 мл. Вероятность того, что истинное число выше 1325 сперматозоидов в эякуляте, составляет всего 0,5%.
Таблица A.1 - Возможные количества сперматозоидов, исследованные в эякулятах различных объемов, при отсутствии сперматозоидов в аликвоте эякулянта объемом 20 мкл
|
Доверительный интервал, % |
Объем эякулята, мл | ||||
|
1 |
2 |
3 |
4 |
5 | |
|
95 |
50 |
100 |
150 |
200 |
250 |
|
97,5 |
185 |
369 |
554 |
738 |
923 |
|
99,5 |
265 |
530 |
795 |
1060 |
1325 |
Приложение B
(справочное)
Поле большого увеличения
Площадь "поля большого увеличения" (объектив 40x и окуляр 10x) варьируется в зависимости от типа используемого окуляра. В микроскопах более ранних модификаций поле зрения значительно меньше, чем в современных "широкопольных" окулярах. Для правильной оценки подходящего разведения для оценки концентрации сперматозоидов следует установить область поля большого увеличения микроскопа, используемого для первоначальной оценки. В таблице B.1 приведены примеры взаимосвязи между площадью поля (диаметр поля, измеренный с помощью калиброванного предметного стекла микроскопа) и соотношением количества наблюдаемых сперматозоидов и концентрации эякулята.
Таблица B.1 - Примеры соотношения между площадью поля и соотношением количества наблюдаемых сперматозоидов и концентрации эякулята
|
Тип окуляра |
Диаметр поля, мм |
Площадь поля π·r2, мм2 |
Объем поля (глубина 20 мкм), нл |
Видимые сперматозоиды | |||
|
1 |
15 |
40 |
200 | ||||
|
Концентрация эякулята (106/мл) | |||||||
|
Широкопольный |
0,53 |
0,22 |
4,4 |
0,2 |
3,0 |
9,0 |
45,0 |
|
Стандартный |
0,38 |
0,11 |
2,3 |
0,4 |
7,0 |
18,0 |
88,0 |
Приложение C
(справочное)
Обучение исследованию подвижности сперматозоидов
Обучение исследованию подвижности сперматозоидов является необходимым условием для надлежащего исследования спермы человека. Теоретическое понимание категорий подвижности сперматозоидов должно сочетаться с достаточной практической подготовкой по правильной классификации сперматозоидов с различными классами подвижности (см. рисунок C.1). Для диагностики пациента необходимо определить, содержит ли эякулят достаточное количество сперматозоидов с поступательной подвижностью, необходимой для того, чтобы продвинуться через цервикальную слизь и достигнуть места оплодотворения.
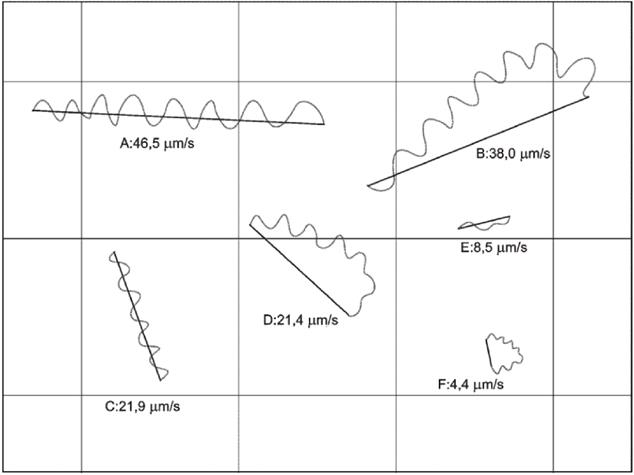
Примечание - Сетка счетной камеры имеет размер стороны ячейки 25 мкм для облегчения визуальной классификации подвижности поступательного движения.
A и B - быстрая поступательная подвижность сперматозоидов; C, D и E - медленная поступательная подвижность сперматозоидов; F - непоступательное круговое движение
Рисунок C.1 - Иллюстрация движения подвижных сперматозоидов, показывающая, как устанавливаются классы подвижности на основе прироста пространства
Цель обучения
Стандартизация подходов к классификации сперматозоидов в зависимости от их подвижности в один из четырех классов:
a) быстрая поступательная подвижность сперматозоида (активные движения хвоста сперматозоида, скорость поступательного движения не менее 25 мкм/с);
b) медленная поступательная подвижность сперматозоида (активные движения хвоста сперматозоида, скорость поступательного движения от 5 до 24 мкм/с);
c) непоступательная подвижность сперматозоида (активные движения хвоста сперматозоида со скоростью движения от 0 до 4 мкм/с);
d) отсутствие подвижности сперматозоида (без активных движений хвоста сперматозоида).
Примечание - Это не означает, что оценивают точную скорость каждого сперматозоида. В рамках исследования каждый сперматозоид классифицируют к конкретному классу подвижности.
Учебные материалы
Образцы спермы, микроскоп с видеокамерой и дисплеем:
- для первоначального ознакомления рекомендуется проводить обучение вместе с опытным специалистом;
- рекомендуется иметь на дисплее сетку счетной камеры с квадратами, откалиброванными в соответствии с размерами 25 x 25 мкм, чтобы облегчить различие между сперматозоидами с быстрой поступательной подвижностью и сперматозоидами с медленной поступательной подвижностью (см. рисунок C.2).
Изображения видеопоследовательностей:
- эякуляты с широким диапазоном концентрации сперматозоидов и распределения подвижности;
- не менее чем с пятью различными полями микроскопа, позволяющими оценить в общей сложности не менее 200 сперматозоидов;
- рекомендуется иметь сетку счетной камеры с квадратами либо на дисплее (например, см. рисунок C.2), либо наложенную на изображение видеопоследовательности и откалиброванную в соответствии с размерами 25 x 25 мкм, чтобы облегчить различие между быстрой и медленной поступательными подвижностями сперматозоидов.
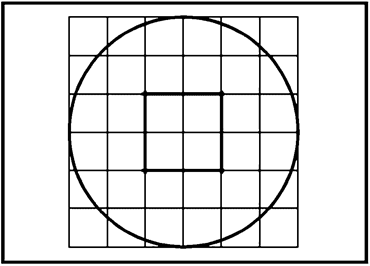
Рисунок C.2 - Пример наложения для видеомонитора, используемого для определения подвижности сперматозоидов пациента (адаптировано из [14])
Окружность изображает поле зрения, сравнимое с полем зрения под микроскопом, а центральная группа из четырех прямоугольников, обозначенная утолщенной линией, используется для определения меньшей площади поля для облегчения подсчета при высокой концентрации сперматозоидов. Линии сетки счетной камеры располагают на расстоянии 25 мкм друг от друга после калибровки (с помощью предметного микрометра), поэтому, если сперматозоид пересекает расстояние за 1 с, его можно классифицировать как имеющий скорость движения не менее 25 мкм/с, т.е. этот сперматозоид относится к классу с "быстрой поступательной подвижностью".
Наложение зависит от конкретной комбинации оптических элементов (модель микроскопа, объектив, промежуточное увеличение, коэффициент увеличения, если оптика не имеет коррекции на бесконечность, адаптер камеры, окуляр камеры, если используется, и модель видеокамеры). Если в лаборатории применяют несколько комбинаций, то для каждой комбинации требуется собственное откалиброванное наложение.
Учебный процесс
Базовое введение в принципы подвижности сперматозоидов:
- теоретические занятия: объяснение классов подвижности сперматозоидов;
- практические занятия: просмотр нескольких изображений видеопоследовательностей эякулята вместе с опытным специалистом для определения класса в зависимости от подвижности сперматозоидов.
Целенаправленное обучение [14], [12]:
- дают неопытному специалисту серию зарегистрированных образцов спермы (первоначально может быть меньшее количество, например восемь образцов, позже до 20 образцов) с известными целевыми значениями, полученными опытными специалистами, регулярно участвующими в межлабораторных сличениях, которые подтвердили квалификацию, получив точный результат исследования подвижности сперматозоидов на материале с валидированными контрольными значениями;
- когда оценка серии зарегистрированных образцов спермы завершена, результаты каждого образца сравнивают с известными целевыми значениями для определения процента подвижных сперматозоидов (a + b + c), процента сперматозоидов с поступательной подвижностью (a + b) и процента сперматозоидов с быстрой поступательной подвижностью (a) соответственно;
- разницу результатов исследования вычисляют как результат неопытного специалиста, вычтенный из результата опытных специалистов.
Примечание - Отрицательная разница указывает на то, что неопытный специалист неправильно классифицировал класс сперматозоидов;
- вычисляют среднее значение разности результатов, стандартное отклонение и 95%-ный доверительный интервал среднего значения;
- после оценки каждой серии зарегистрированных образцов неопытного специалиста дается обратная связь с опытным специалистом для разъяснения заниженных и завышенных результатов;
- обучение выполняют путем повторения серии зарегистрированных образцов до тех пор, пока неопытный специалист не получит среднюю разницу результатов 0% (± 1%) с погрешностью измерения (95%-ный доверительный интервал) менее ± 10%, а для исследования сперматозоидов с быстрой поступательной подвижностью и медленной поступательной подвижностью - ± 5%.
Переподготовка
Сотрудникам, возвращающимся к работе в лаборатории после продолжительного перерыва (например, более 6 мес) или после получения результатов внутреннего контроля качества, не соответствующих стандартам лаборатории, настоятельно рекомендуют пройти переподготовку путем изучения 20 комплектов, состоящих из 30 зарегистрированных образцов спермы (архивный материал с известными целевыми значениями), для достижения такой же цели, как и для начального процесса обучения.
Приложение D
(справочное)
Разбавитель для исследования концентрации сперматозоидов
Готовят водный раствор, содержащий 0,595 М бикарбоната натрия и приблизительно 0,14 М формальдегида. Например, для приготовления 1 л:
1) растворяют 50,0 г NaHCO3 примерно в 500 мл дистиллированной воды, добавляют 10,0 мл 36 - 40%-ного раствора формальдегида (примерно 13,3 моль/л) и добавляют воду объемом не более 1000 мл;
2) хранят при температуре от 2 °C до 8 °C не более 12 мес;
3) если образуются кристаллы, отфильтровывают раствор.
Приложение E
(справочное)
Определение необходимого разведения спермы для исследований концентрации сперматозоидов
Определение необходимого разведения эякулята для оценки концентрации сперматозоидов с использованием усовершенствованного гемоцитометра Нэйбауэра в 6.3.5: в среднем на поле микроскопа с использованием объектива 40x.
Для разведения используют не менее 50 мкл эякулята. Вместо этого изменяют объем разбавителя для получения требуемого разбавления. Для разведения 1:5 рекомендуется 100 мкл эякулята + 400 мкл разбавителя, чтобы обеспечить достаточный объем для смешивания и оценки (см. таблицу E.1).
Таблица E.1 - Соотношение между количеством сперматозоидов в поле микроскопа и подходящим разведением
|
Сперматозоиды в поле микроскопа, 40x объектив |
Разбавление |
Объем аликвоты эякулята, мкл |
Объем разбавителя, мкл |
|
Менее 15 |
1:5 (1 + 4) |
100 |
400 |
|
От 15 до 40 |
1:10 (1 + 9) |
50 |
450 |
|
От 41 до 200 |
1:20 (1 + 19) |
50 |
950 |
|
Более 200 |
1:50 (1 + 49) |
50 |
2450 |
Приложение F
(справочное)
Сравнение соответствия между двумя повторными исследованиями, результаты которых выражены в процентах
Данное приложение относится прежде всего к исследованию подвижности сперматозоидов. Каждое повторное исследование с целью классификации подвижности сперматозоидов должно быть, по возможности, проведено не менее чем на 200 сперматозоидах.
1 Для каждого повторного исследования вычисляют процент подвижных и неподвижных сперматозоидов (результат представляют в виде целого числа).
2 Приемлемая сходимость результатов исследования - вероятность того, что разница результатов, зависящая от случайных факторов, составляет <5%, которую вычисляют с учетом вероятностей биномиальных распределений с использованием асимметричных доверительных интервалов [14].
3 Вычисляют разницу результатов между повторными исследованиями, используя большее из значений вычисленных процентов подвижных или неподвижных сперматозоидов.
4 Сравнивают вычисленную разницу результатов в процентах между повторными исследованиями отдельно для подвижных и неподвижных сперматозоидов с предельными значениями, указанными в таблице F.1:
a) находят строку, в которой указан диапазон средних значений повторных результатов;
b) если разница результатов меньше или равна предельному значению, то результаты двух повторных исследований являются сходимыми.
Таблица F.1 - Предельные значения, %, для определения разницы результатов между повторными исследованиями
|
Среднее значение, % |
Предельное значение |
|
1 |
2 |
|
От 02 до 03 |
3 |
|
От 04 до 06 |
4 |
|
От 07 до 09 |
5 |
|
От 10 до 13 |
6 |
|
От 14 до 19 |
7 |
|
От 20 до 27 |
8 |
|
От 28 до 44 |
9 |
|
От 45 до 55 |
10 |
|
От 56 до 72 |
9 |
|
От 73 до 80 |
8 |
|
От 81 до 86 |
7 |
|
От 87 до 90 |
6 |
|
От 91 до 93 |
5 |
|
От 94 до 96 |
4 |
|
От 97 до 98 |
3 |
|
99 |
2 |
5 Действия:
a) если повторные исследования являются сходимыми, то средние значения для различных категорий подвижности сперматозоида представляют как результаты образца;
b) если результаты двух повторных исследований недостаточно близки, то они являются неприемлемыми, и в таком случае необходимо проведение повторных исследований;
c) если повторное исследование не показывает достаточной сходимости для трех повторных исследований, то среднее значение вычисляют с использованием всех шести повторных исследований, и в протокол включают комментарий о том, что результат основан на среднем значении исследований, не имеющих достаточной сходимости.
Приложение G
(справочное)
Сравнение соответствия между двумя повторными вычислениями концентрации сперматозоидов
Каждое повторное вычисление концентрации сперматозоидов должно быть, по возможности, проведено не менее чем на 200 сперматозоидах в гемоцитометре с камерой Нэйбауэра (см. рисунок G.1).
Для повторных вычислений концентрации применяют одинаковый объем суспензии сперматозоидов.
1 Сходимость результатов исследований - вероятность того, что разница результатов, зависящая от случайных факторов, составляет <5%, которую вычисляют с учетом вероятностей биномиальных распределений с использованием асимметричных доверительных интервалов [14].
2 Для каждого повтора отмечают общее количество подсчитанных сперматозоидов.
3 Вычисляют как суммарное количество сперматозоидов для двух повторов, так и разницу в количестве сперматозоидов между повторами.
4 Сравнивают разницу значений суммарного количества сперматозоидов в повторах с предельными значениями (см. таблицу G.1):
a) находят строку, в которой указан диапазон значений суммарного количества сперматозоидов в повторах;
b) если разница меньше или равна предельному значению, то результаты являются приемлемыми для повторных исследований.
Таблица G.1 - Предельные значения для определения разницы между повторами исследования количества сперматозоидов
|
Диапазон значений суммарного количества сперматозоидов в повторах |
Предельное значение |
|
От 969 до 1000 |
61 |
|
От 938 до 968 |
60 |
|
От 907 до 937 |
59 |
|
От 876 до 906 |
58 |
|
От 846 до 875 |
57 |
|
От 817 до 845 |
56 |
|
От 788 до 816 |
55 |
|
От 760 до 787 |
54 |
|
От 732 до 759 |
53 |
|
От 704 до 731 |
52 |
|
От 678 до 703 |
51 |
|
От 651 до 677 |
50 |
|
От 625 до 650 |
49 |
|
От 600 до 624 |
48 |
|
От 576 до 599 |
47 |
|
От 551 до 575 |
46 |
|
От 528 до 550 |
45 |
|
От 504 до 527 |
44 |
|
От 482 до 503 |
43 |
|
От 460 до 481 |
42 |
|
От 438 до 459 |
41 |
|
От 417 до 437 |
40 |
|
От 396 до 416 |
39 |
|
От 376 до 395 |
38 |
|
От 357 до 375 |
37 |
|
От 338 до 356 |
36 |
|
От 319 до 337 |
35 |
|
От 301 до 318 |
34 |
|
От 284 до 300 |
33 |
|
От 267 до 283 |
32 |
|
От 251 до 266 |
31 |
|
От 235 до 250 |
30 |
|
От 219 до 234 |
29 |
|
От 206 до 218 |
28 |
|
От 190 до 205 |
27 |
|
От 176 до 189 |
26 |
|
От 163 до 175 |
25 |
|
От 150 до 162 |
24 |
|
От 138 до 149 |
23 |
|
От 126 до 137 |
22 |
|
От 115 до 125 |
21 |
|
От 105 до 114 |
20 |
|
От 94 до 104 |
19 |
5 Интерпретация результатов:
a) если результаты повторных исследований приемлемы, то средние значения для каждой концентрации сперматозоидов представляют как результаты образца (см. таблицу G.2);
b) если результаты двух повторных исследований недостаточно близки, то проводят два новых повторных исследования;
c) если повторное исследование не показывает достаточной сходимости для трех повторных исследований, то среднее значение вычисляют с использованием всех шести повторных исследований, и в протокол включают комментарий о том, что результат основан на среднем значении исследований, не имеющих достаточной сходимости;
d) если в каждой повторности подсчитано менее 200 сперматозоидов, то в протоколе должно быть отмечено, что результат концентрации сперматозоидов основан на малом количестве наблюдаемых сперматозоидов.
Таблица G.2 - Поправочные коэффициенты, используемые для вычисления концентрации сперматозоидов в эякуляте при проведении исследования в двух повторностях с учетом объема эякулята и его разведения
|
Разбавление |
Количество больших квадратов сетки счетной камеры, использованных для подсчета |
Количество полей видимости, подсчитанных в каждой камере | |||||||||
|
5 |
10 |
25 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 | |
|
Значения поправочного коэффициента | |||||||||||
|
1:5 |
8 |
16 |
40 |
80 |
120 |
160 |
200 |
240 |
280 |
320 |
360 |
|
1:10 |
4 |
8 |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
160 |
180 |
|
1:20 |
2 |
4 |
10 |
20 |
30 |
40 |
50 |
60 <*> |
70 <*> |
80 <*> |
90 <*> |
|
1:50 |
0,8 |
1,6 |
4 |
8 |
12 <*> |
16 <*> |
20 <*> |
24 <*> |
28 <*> |
32 <*> |
36 <*> |
|
Примечание - Гемоцитометр с камерой Нэйбауэра имеет две счетные камеры. Каждая счетная камера состоит из девяти квадратов (3x3) одинакового размера (см. рисунок G.1). Центральная область состоит из 25 больших квадратов, каждый из которых окружен утолщенной линией, а восемь периферийных квадратов состоят из 20 - 16 квадратов и прямоугольников соответственно. -------------------------------- <*> - указывает на то, что разведение не достаточное. | |||||||||||
Рекомендуемая счетная камера представляет собой гемоцитометр с камерой Нэйбауэра с высокой степенью точности. Могут быть использованы другие валидированные и проверенные счетные камеры, но для них следует разработать таблицы разбавления эякулята и установления расчетных коэффициентов, которые будут обеспечивать достижение эквивалентной точности и прецизионности во время их применения.
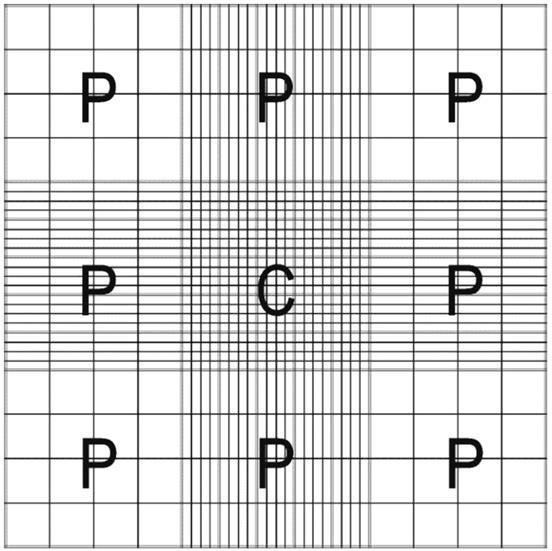
Рисунок G.1 - Внешний вид всей счетной камеры Нэйбауэра 9 больших квадратов одинакового размера: C – центральная область, 25 больших квадратов; P - 8 периферийных квадратов, 20 - 16 квадратов и прямоугольников соответственно (адаптировано из [14])
Приложение H
(справочное)
Исследование жизнеспособности сперматозоидов
Смешивают 30 мкл образца спермы с 30 мкл комбинированного красителя эозиннигрозин и оставляют на 30 с.
Переносят 20 мкл смеси на маркированное чистое предметное стекло микроскопа и наносят тонким слоем (необходимо убедиться в том, что контрастное окрашивание нигрозином не избыточно).
Высушивают на воздухе, а затем накрывают большим покровным стеклом (например, размером 22 x 50 мм).
Изучают не менее 200 сперматозоидов и характеризуют каждый из них как живой или мертвый:
- микроскоп с увеличением 100x под иммерсионным маслом;
- сперматозоиды с неокрашенными головками считают живыми клетками;
- красные или слегка розовые головки сперматозоидов считают мертвыми клетками;
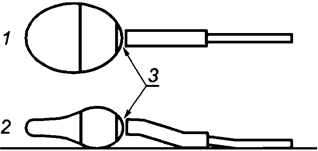
- сперматозоиды со слабой красной или розовой окраской только в месте шейки ("дырявые шейки") считают живыми клетками (см. рисунок H.1);
- нет необходимости проводить исследование дополнительной аликвоты для определения жизнеспособности сперматозоидов.
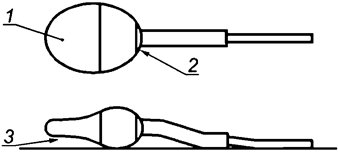
1 - вид сверху; эта область может быть окрашена в светло-фиолетовый цвет; 2 - вид сверху; область розового окрашивания эозином шейки "дырявая шейка"; 3 - вид сбоку; область темно-фиолетового цвета окрашивания нигрозином под головкой сперматозоида
Примечание - Накопление нигрозина под передней частью головки сперматозоида можно спутать с окрашиванием эозином, а следовательно, появление "дырявой шейки" не указывает на гибель клеток.
Рисунок H.1 - Схемы, иллюстрирующие две распространенные проблемы, возникающие при интерпретации результатов исследования жизнеспособности сперматозоидов при окрашивании эозином-нигрозином (адаптировано из [14])
Если используют отдельные красители эозин и нигрозин, то следует соблюдать объемы и пропорции их смешивания, как описано выше.
Настоятельно рекомендуется проводить пробоподготовку витальных мазков для защиты от случайных изменений, например от конденсации влаги на их поверхности, что позволит эозину мигрировать из витального мазка в высушенные (т.е. уже мертвые) клетки.
Приложение I
(справочное)
Исследование морфологии сперматозоида
Используя аликвоты по 10 мкл из тщательно перемешанного эякулята, готовят мазки на чистых, промаркированных предметных стеклах.
Перед фиксацией и окрашиванием дают мазкам высохнуть на воздухе. Метод окрашивания по Папаниколау, адаптированный для спермы пациента, рекомендуется как приоритетный метод окрашивания [14].
После окрашивания мазков на предметных стеклах их накрывают покрывными стеклами большого размера (например, 24 x 50 мм).
Необходимость проводить исследование повторной аликвоты отсутствует в случае применения валидированного метода [11].
Для исследования необходимо изучить не менее 200 целых сперматозоидов для определения нормальной морфологии или аномалий головки, шейки/средней части, хвоста сперматозоида или остаточной цитоплазматической массы (ранее "цитоплазматическая капля") (строгие критерии Тайгерберга, см. [10]). Обращают внимание на то, что отнесение сперматозоида к аномальным проводят по наличию по крайней мере одной дефектной области, но сперматозоид может иметь до четырех дефектных областей, и все они должны быть подсчитаны в рамках исследования (см. рисунок I.1). Любую специфическую аномалию, встречающуюся более чем в 20% сперматозоидов, фиксируют отдельно в протоколе и включают в общий расчет. Если на 100 целых сперматозоидов приходится более 20 свободных головок, то количество свободных головок указывают отдельно как количество свободных головок на 100 целых сперматозоидов и не включают в подсчет аномальных сперматозоидов. В процессе исследования могут быть выявлены артефакты, которые не следует регистрировать как отклонения (см. рисунок I.2).
Примечание - Различные методы фиксации и окрашивания могут вызывать переменное набухание или сморщивание головки сперматозоида. При определении того, является ли головка сперматозоида меньше или больше нормальной формы, необходимо использовать соответствующие размеры головки, установленные для различных методов окраски препаратов, например в препаратах, окрашенных по Папаниколау, нормальная головка сперматозоида имеет размеры 4,3 мкм в длину и 2,7 мкм в ширину [8].
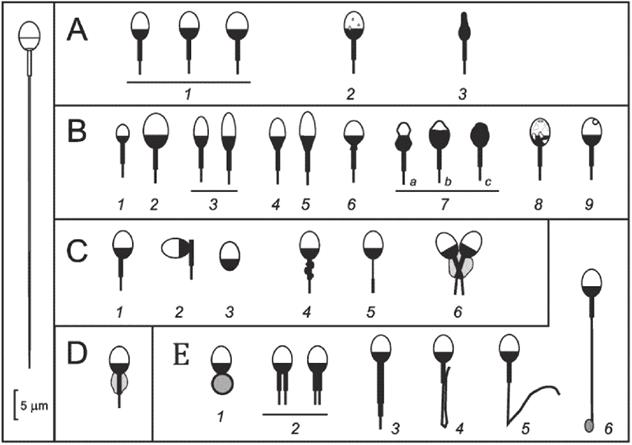
A - нормальная форма головки сперматозоида: 1 – формы сперматозоидов; 2 - головка нормального размера и формы с несколькими вакуолями (занимающими менее 20% площади головки нормального размера); 3 - вид сбоку сперматозоида; B - вариации размера/формы головки сперматозоида: 1 - маленькая форма головки; 2 - большая форма головки; 3 - конусовидная форма головки (отношение длины к ширине более 2:1); 4 - грушевидная форма головки; 5 - комбинированная конусовидная и грушевидная форма головки; 6 - суженная задняя область сперматозоида ("сжатая шейка"); 7 - аморфные формы сперматозоида (a - суженные; b - редуцированная акросома; c – плотное окрашивание/отсутствие акросомы); 8 – вакуолизированная форма головки; 9 - кратерный дефект; C – дефекты шейки/средней части сперматозоида: 1 – асимметричное прикрепление средней части к головке (гетероаксиальность); 2 - невставленный хвост; 3 - отсутствует хвост; 4 - растянутая средняя часть (обычно окрашивается красным цветом по Папаниколау); 5 - аномально тонкая средняя часть (без митохондрий); 6 - соединенная форма (слияние средней части); D - остаточная цитоплазма (ранее называвшаяся "цитоплазматическая капля"), которая составляет более 1/3 площади нормального размера головы (обычно окрашивается зеленым цветом по Папаниколау); E - дефекты хвоста сперматозоида: 1 - скрученный хвост; 2 - множественный хвост (может быть больше двух хвостов); 3 - короткий хвост; 4 - шпилькообразный хвост; 5 - согнутый хвост (угол менее 90°); 6 - хвост с каплеобразным окончанием
Рисунок I.1 - Схемы, иллюстрирующие внешний вид нормального сперматозоида пациента и ряд обычно описываемых морфологических аномалий (адаптировано [14])
1 - вид сверху сперматозоида; 2 - вид сбоку сперматозоида; 3 - усадка в процессе окрашивания может привести к отделению хвоста сперматозоида от головки сперматозоида
Рисунок I.2 - Схемы, показывающие, как происходит усадка при сушке, фиксации и окрашивании мазков для исследования морфологии сперматозоидов, которые могут привести к искусственному отделению хвоста сперматозоида от головки, оставляя небольшой зазор между средней частью и базальной поверхностью головы (адаптировано из [14])
Результаты вычисляют следующим образом:
- как процент нормальных сперматозоидов (результат представляют как целое число);
- распространенность каждого типа аномалий на 100 сперматозоидов (результат представляют как целое число);
- при необходимости, индекс TZI вычисляют как сумму подсчитанных аномальных участков, разделенную на количество аномальных сперматозоидов, из которых они подсчитаны. TZI представляют числовым значением от 1,00 до 4,00 с точностью до двух десятичных знаков.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
|
Обозначение ссылочного международного стандарта |
Степень соответствия |
Обозначение и наименование соответствующего национального стандарта |
|
ISO 15189 |
IDT |
ГОСТ Р ИСО 15189-2015 "Лаборатории медицинские. Частные требования к качеству и компетентности" |
|
ISO/TS 20914 |
IDT |
ГОСТ Р 70413-2022/ISO/TS 20914:2019 "Лаборатории медицинские. Практическое руководство по оценке неопределенности измерений" |
|
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
|
[1] |
Barratt C.L., Björndahl L., Menkveld R., Mortimer D. ESHRE special interest group for andrology basic semen analysis course: a continued focus on accuracy, quality, efficiency and clinical relevance. Hum Reprod 2011 26 3207 - 3212 |
|
[2] |
Björndahl L., Söderlund I., Kvist U., Evaluation of the one-step eosin-nigrosin staining technique for human sperm vitality assessment. Hum Reprod 2003 18 813 - 816 |
|
[3] |
Cooper T.G., Brazil C., Swan S.H., Overstreet J.W. Ejaculate volume is seriously underestimated when semen is pipetted or decanted into cylinders from the collection vessel. J Androl 2007 28 1 - 4 |
|
[4] |
Douglas-Hamilton D.H., Smith N.G., Kuster C.E., Vermeiden J.P., Althouse G.C. Capillary-loaded particle fluid dynamics: effect on estimation of sperm concentration. Journal of andrology. 2005 26(1): 115 - 22 |
|
[5] |
Kirkman-Brown J., Björndahl L. Evaluation of a disposable plastic Neubauer counting chamber for semen analysis. Fertil Steril 2009 91 627 - 631 |
|
[6] |
Long S., Woodward B., Tomlinson M. Sperm toxicity testing: UK best practice guideline from the Association of Biomedical Andrologists. British Journal of Biomedical Science 2018 75(2): 53 - 60 |
|
[7] |
MacLeod J., Gold R.Z. The male factor in fertility and infertility. III. An analysis of motile activity in the spermatozoa of 1000 fertile men and 1000 men in infertile marriage. Fertil Steril 1951 2187 - 204 |
|
[8] |
Maree L., du Plessis S.S., Menkveld R., van der Horst G. Morphometric dimensions of the human sperm head depend on the staining method used. Human reproduction (Oxford, England). 2010 25(6): 1369 - 82 |
|
[9] |
Menkveld R., Franken D.R., Kruger T.F., Oehninger S., Hodgen G.D. Sperm selection capacity of the human zona pellucida. Mol Reprod Dev 1991 30 346 - 352 |
|
[10] |
Menkveld R., Kruger T.F. Advantages of strict (Tygerberg) criteria for evaluation of sperm morphology. Int J Androl 1995 18 Suppl 2 36 - 42 |
|
[11] |
Menkveld R., Wong W.Y., Lombard C.J., Wetzels A.M., Thomas C.M., Merkus H.M., Steegers Theunissen R.P. Semen parameters, including WHO and strict criteria morphology, in a fertile and subfertile population: an effort towards standardization of in-vivo thresholds. Hum Reprod 2001 16 1165 - 1171 |
|
[12] |
Mortimer D. Practical Laboratory Andrology. Oxford: Oxford University Press, 1994 |
|
[13] |
Mortimer D., Barratt C.L., Björndahl L., de Jager C., Jequier A.M., Muller C.H. What should it take to describe a substance or product as 'sperm-safe'. Hum Reprod Update 2013 19 Suppl 1 i1 - 45 |
|
[14] |
Mortimer D., Björndahl L., Barratt C.L.R., Castilla J.A., Menkveld R., Kvist U., Alvarez J.G., Haugen T.B. A practical guide to basic laboratory andrology. Cambridge, UK; New York: Cambridge University Press, 2021 |
|
[15] |
Mortimer D., Menkveld R. Sperm morphology assessment - historical perspectives and current opinions. J Androl 2001 22 192 - 205. |
|
[16] |
World Health Organization, WHO laboratory manual for the examination and processing of human semen. Geneva: World Health Organization, 2010 |
|
[17] |
Zuvela E., Matson P. Performance of four chambers to measure sperm concentration: results from an external quality assurance programme. Reproductive biomedicine online. 2020 41 (4):671 - 8 |
|
[18] |
ISO 15189:2012, Medical laboratories - Requirements for quality and competence |
|
[19] |
ISO 15190:2020, Medical laboratories - Requirements for safety |
|
[20] |
ISO/TS 20914:2019, Medical laboratories - Practical guidance for the estimation of measurement uncertainty |
|
[21] |
ISO/IEC 17043:2010, Conformity assessment - General requirements for proficiency testing |
(Нет голосов) |
-
12.04.2024
Названы города России с самым доступным жильем
 Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
Городом с самыми дешевыми квартирами в новостройках оказался Воронеж
-
12.04.2024
Россиянам назвали лучшее время для продажи дачи
 Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
Аналитик Гутман: период с мая по июль является лучшим периодом для продажи дачи
-
12.04.2024
Предсказано будущее рынка жилья в России
 «МК»: в России не отменят льготную ипотеку
«МК»: в России не отменят льготную ипотеку
-
12.04.2024
В Москве подешевела аренда квартир
 Аренда квартир в Москве подешевела на 10 %
Аренда квартир в Москве подешевела на 10 %
-
22.03.2024
Хуснуллин назвал необходимый размер ставки по ипотеке
 Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов
Вице-премьер Хуснуллин: ставка по ипотеке должна быть пять процентов